Elektrokimia: Prinsip dan Aplikasi dalam Baterai, Selamat datang di panduan komprehensif tentang elektrokimia dan bagaimana prinsip-prinsipnya diterapkan dalam baterai. Di era teknologi saat ini, baterai memainkan peran yang sangat penting dalam kehidupan sehari-hari kita.
Dari smartphone hingga kendaraan listrik, baterai adalah sumber energi utama. Namun, bagaimana sebenarnya baterai bekerja? Inilah yang akan kita eksplorasi dalam artikel ini dengan memanfaatkan konsep elektrokimia.
Apa Itu Elektrokimia?
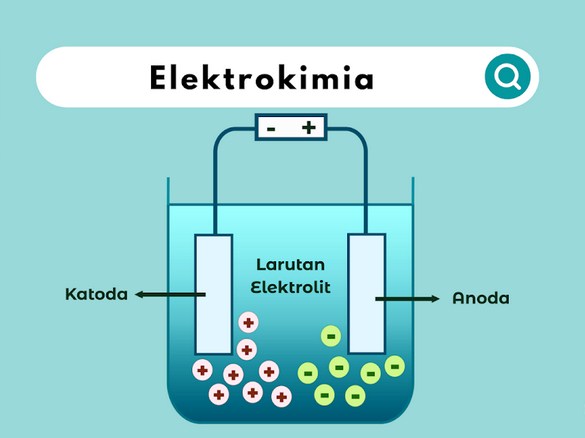
Definisi Elektrokimia
Elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara energi listrik dan reaksi kimia. Konsep dasar elektrokimia melibatkan penggunaan atau pembangkitan listrik melalui reaksi kimia. Ini sangat penting dalam banyak aplikasi teknologi modern, termasuk baterai, korosi, dan proses elektroplating.
Prinsip Dasar Elektrokimia
Elektrokimia adalah cabang ilmu kimia yang mempelajari hubungan antara energi listrik dan reaksi kimia. Prinsip dasar elektrokimia menggabungkan konsep kimia dan fisika untuk memahami bagaimana reaksi kimia dapat menghasilkan energi listrik dan sebaliknya, bagaimana energi listrik dapat mendorong reaksi kimia. Berikut adalah beberapa prinsip dasar yang mendasari elektrokimia:
1. Reaksi Redoks (Reduksi-Oksidasi)
- Definisi: Reaksi redoks adalah reaksi kimia di mana terjadi transfer elektron antara dua spesies. Dalam reaksi ini, satu zat mengalami oksidasi (kehilangan elektron) dan zat lainnya mengalami reduksi (menerima elektron).
- Contoh: Reaksi antara hidrogen dan oksigen untuk membentuk air adalah contoh reaksi redoks, di mana hidrogen mengalami oksidasi dan oksigen mengalami reduksi.
2. Sel Elektrokimia
- Definisi: Sel elektrokimia adalah perangkat yang mengubah energi kimia menjadi energi listrik atau sebaliknya. Sel ini terdiri dari dua elektroda (anoda dan katoda) yang dipisahkan oleh larutan elektrolit.
- Sel Galvani: Juga dikenal sebagai sel volta, sel galvani menghasilkan listrik dari reaksi redoks spontan. Contoh sederhana adalah sel galvanik yang terbuat dari logam seperti seng dan tembaga.
- Sel Elektrolisis: Sel elektrolisis menggunakan energi listrik untuk memicu reaksi kimia non-spontan. Contoh umum adalah elektrolisis air untuk menghasilkan hidrogen dan oksigen.
3. Potensial Elektrode
- Definisi: Potensial elektrode adalah ukuran kemampuan suatu elektroda untuk menarik atau melepaskan elektron dalam larutan. Potensial ini diukur dalam volt dan digunakan untuk menentukan arah dan kekuatan reaksi redoks.
- Potensial Standar Elektrode: Potensial elektrode diukur dalam kondisi standar (25°C, 1 atm, dan 1 M) dan digunakan sebagai referensi untuk membandingkan berbagai elektroda.
4. Hukum Faraday
- Hukum Faraday I: Jumlah zat yang terdeposisi atau diubah pada elektroda selama elektrolisis sebanding dengan jumlah listrik yang digunakan. Secara matematis, hukum ini dinyatakan sebagai: m=QF⋅1n⋅Mm = \frac{Q}{F} \cdot \frac{1}{n} \cdot M, di mana mm adalah massa zat, QQ adalah jumlah muatan, FF adalah konstanta Faraday, nn adalah jumlah elektron yang terlibat, dan MM adalah massa molar.
- Hukum Faraday II: Jumlah listrik yang diperlukan untuk mengubah satu mol zat pada elektroda adalah konstan dan disebut konstanta Faraday, yang memiliki nilai sekitar 96485 C/mol.
5. Elektrolit dan Konduktivitas
- Definisi: Elektrolit adalah zat yang dapat mengion dalam larutan dan memungkinkan aliran listrik. Elektrolit dibagi menjadi dua kategori: elektrolit kuat (yang terionisasi sepenuhnya) dan elektrolit lemah (yang terionisasi sebagian).
- Konduktivitas: Konduktivitas adalah kemampuan larutan elektrolit untuk menghantarkan arus listrik. Konduktivitas tergantung pada konsentrasi ion dalam larutan dan jenis elektrolit.
6. Diagram Sel Elektrokimia
- Representasi Sel: Diagram sel elektrokimia digunakan untuk menggambarkan komponen dan reaksi dalam sel elektrokimia. Diagram ini biasanya menunjukkan dua elektroda, larutan elektrolit, dan arus listrik yang mengalir antara elektroda.
- Contoh: Diagram sel galvanik dapat digambarkan sebagai: Anoda∣Larutan∣Katoda\text{Anoda} | \text{Larutan} | \text{Katoda}, di mana anoda adalah tempat terjadinya oksidasi, dan katoda adalah tempat terjadinya reduksi.
7. Energi Sel dan Selisih Potensial
- Selisih Potensial: Energi sel (atau gaya elektromotif, EMF) adalah perbedaan potensial antara dua elektroda dalam sel elektrokimia. Selisih potensial ini mengukur seberapa banyak energi listrik yang dapat dihasilkan oleh sel.
- Hubungan dengan Energi Gibbs: Hubungan antara selisih potensial dan perubahan energi Gibbs (ΔG) dinyatakan dalam persamaan: ΔG=−nFE\Delta G = -nFE, di mana nn adalah jumlah mol elektron, FF adalah konstanta Faraday, dan EE adalah selisih potensial.
8. Efek Koncentrasi dan Tegangan
- Efek Koncentrasi: Konsentrasi ion dalam larutan dapat mempengaruhi potensial elektrode dan kinerja sel elektrokimia. Persamaan Nernst digunakan untuk menghitung potensial elektrode berdasarkan konsentrasi ion.
- Efek Tegangan: Tegangan yang diterapkan pada sel elektrolisis mempengaruhi laju reaksi dan produk yang dihasilkan. Tegangan yang terlalu tinggi dapat menyebabkan pembentukan produk sampingan atau reaksi yang tidak diinginkan.
9. Elektrolisis dan Aplikasi Praktis
- Elektrolisis: Proses elektrolisis digunakan untuk memisahkan zat kimia dari larutannya, seperti pemisahan air menjadi hidrogen dan oksigen atau pemurnian logam. Ini adalah aplikasi praktis dari prinsip elektrokimia yang banyak digunakan dalam industri.
- Aplikasi Lain: Elektrokimia juga digunakan dalam pembuatan baterai, superkapasitor, dan sel bahan bakar, yang merupakan teknologi penting dalam penyimpanan energi dan sumber energi terbarukan.
Prinsip dasar elektrokimia mencakup pemahaman tentang reaksi redoks, sel elektrokimia, potensial elektrode, hukum Faraday, dan konduktivitas elektrolit. Dengan memahami prinsip-prinsip ini, kita dapat memanfaatkan energi listrik untuk berbagai aplikasi kimia dan industri, serta mengembangkan teknologi yang efisien dan ramah lingkungan.
Elektrokimia tidak hanya penting dalam sains dasar tetapi juga memiliki banyak aplikasi praktis dalam kehidupan sehari-hari dan industri modern.
Bagaimana Baterai Bekerja?
Komponen Utama Baterai
Baterai adalah perangkat yang menyimpan energi kimia dan mengubahnya menjadi energi listrik melalui reaksi elektrokimia. Setiap baterai terdiri dari beberapa komponen utama yang bekerja bersama untuk menghasilkan arus listrik.
Memahami komponen-komponen ini penting untuk memahami cara kerja baterai serta mengoptimalkan penggunaannya dalam berbagai aplikasi. Berikut adalah komponen utama baterai:
1. Elektroda
- Elektroda Positif (Katoda): Ini adalah elektroda di mana reaksi reduksi terjadi. Katoda biasanya terbuat dari bahan yang memiliki potensi elektroda positif, seperti mangan dioksida dalam baterai alkaline atau litium kobalt oksida dalam baterai lithium-ion. Selama discharge (penggunaan baterai), katoda menerima elektron dan menjadi lebih stabil secara kimiawi.
- Elektroda Negatif (Anoda): Ini adalah elektroda di mana reaksi oksidasi terjadi. Anoda biasanya terbuat dari bahan yang memiliki potensi elektroda negatif, seperti seng dalam baterai alkaline atau grafit dalam baterai lithium-ion. Selama discharge, anoda melepaskan elektron dan mengalami perubahan kimiawi.
2. Elektrolit
- Definisi: Elektrolit adalah larutan atau substansi yang mengandung ion dan memungkinkan aliran elektron antara elektroda. Elektrolit berfungsi sebagai media konduktif yang menghubungkan elektroda positif dan negatif, memungkinkan terjadinya reaksi elektrokimia.
- Tipe Elektrolit: Elektrolit dapat berupa cairan, gel, atau padat, tergantung pada jenis baterai. Contoh elektrolit cair termasuk larutan asam sulfat dalam baterai timbal-asam, sedangkan elektrolit padat digunakan dalam baterai solid-state.
3. Separator
- Definisi: Separator adalah bahan yang memisahkan elektroda positif dan negatif dalam baterai. Fungsinya adalah untuk mencegah kontak langsung antara elektroda yang dapat menyebabkan short circuit (hubungan pendek) dan untuk memastikan bahwa aliran ion tetap terjaga.
- Material Separator: Separator biasanya terbuat dari bahan berpori, seperti polietilen atau polipropilen, yang memungkinkan ion untuk bergerak bebas antara elektroda tetapi mencegah kontak langsung antara elektroda.
4. Kasing atau Casing
- Definisi: Kasing adalah struktur luar yang melindungi dan menahan semua komponen internal baterai. Kasing bertugas untuk memberikan kekuatan mekanik, melindungi komponen dari kerusakan fisik, dan menjaga keamanan baterai.
- Material Kasing: Kasing baterai biasanya terbuat dari bahan logam seperti baja atau aluminium, atau bahan plastik tahan lama, tergantung pada jenis baterai dan aplikasinya.
5. Terminal
- Definisi: Terminal adalah titik koneksi eksternal dari baterai yang memungkinkan baterai untuk dihubungkan dengan perangkat elektronik. Terminal biasanya terdiri dari dua terminal yang terhubung dengan elektroda positif dan negatif.
- Fungsi Terminal: Terminal berfungsi sebagai titik penghubung untuk arus listrik yang dihasilkan oleh baterai. Terminal harus dirancang untuk memastikan koneksi yang baik dengan perangkat dan meminimalkan resistansi kontak.
6. Bahan Aktif
- Definisi: Bahan aktif adalah substansi yang terlibat langsung dalam reaksi elektrokimia di elektroda. Bahan ini berperan penting dalam menentukan kapasitas, tegangan, dan umur pakai baterai.
- Contoh Bahan Aktif: Dalam baterai timbal-asam, bahan aktif di katoda adalah timbal dioksida, sedangkan di anoda adalah timbal. Dalam baterai lithium-ion, bahan aktif di katoda bisa berupa litium kobalt oksida, dan di anoda biasanya grafit.
7. Pelindung atau Safety Features
- Definisi: Fitur pelindung dalam baterai dirancang untuk mencegah kerusakan atau kecelakaan. Ini termasuk mekanisme untuk mencegah overcharging, overheating, dan korsleting.
- Contoh: Fitur pelindung bisa berupa fuse (sekring) yang memutus arus jika baterai terlalu panas atau baterai dilengkapi dengan sirkuit pengaman untuk mengontrol aliran listrik dan mencegah kondisi berbahaya.
Komponen utama baterai meliputi elektroda, elektrolit, separator, kasing, terminal, bahan aktif, dan fitur pelindung. Masing-masing komponen memiliki peran penting dalam memastikan baterai berfungsi dengan baik, aman, dan efisien.
Memahami komponen-komponen ini membantu kita untuk memilih baterai yang tepat untuk aplikasi tertentu dan memperpanjang umur pakai baterai dengan memastikan perawatan dan penggunaan yang benar.
Reaksi Kimia dalam Baterai
Reaksi kimia dalam baterai adalah proses utama yang memungkinkan baterai menyimpan dan melepaskan energi listrik. Selama proses discharge (penggunaan) dan charge (pengisian), terjadi reaksi kimia yang melibatkan transfer elektron antara elektroda, menghasilkan aliran listrik yang dapat digunakan untuk mengoperasikan perangkat. Berikut adalah penjelasan tentang berbagai reaksi kimia yang terjadi dalam baterai:
1. Reaksi Redoks dalam Baterai
- Definisi: Reaksi redoks (reduksi-oksidasi) adalah jenis reaksi kimia yang terjadi dalam baterai. Dalam reaksi ini, satu zat mengalami oksidasi (kehilangan elektron), sementara zat lain mengalami reduksi (menerima elektron).
- Contoh: Dalam baterai timbal-asam, reaksi redoks melibatkan timbal (Pb) dan timbal dioksida (PbO₂). Ketika baterai digunakan, timbal di anoda mengalami oksidasi, melepaskan elektron, sementara timbal dioksida di katoda mengalami reduksi, menerima elektron.
2. Reaksi dalam Baterai Timbal-Asam
- Reaksi Discharge:
- Anoda (oksidasi): Pb + SO₄²⁻ → PbSO₄ + 2e⁻
- Katoda (reduksi): PbO₂ + 3H₂SO₄ + 2e⁻ → PbSO₄ + 2H₂O
Selama discharge, timbal (Pb) di anoda mengalami oksidasi, menghasilkan timbal sulfat (PbSO₄) dan elektron. Di katoda, timbal dioksida (PbO₂) bereaksi dengan asam sulfat (H₂SO₄) dan elektron untuk membentuk timbal sulfat (PbSO₄) dan air (H₂O).
- Reaksi Charge:
- Anoda (reduksi): PbSO₄ + 2H₂O → Pb + SO₄²⁻ + 2H₂SO₄ + 2e⁻
- Katoda (oksidasi): PbSO₄ + 2H₂O → PbO₂ + 2H₂SO₄ + 2e⁻
Selama pengisian, timbal sulfat (PbSO₄) di anoda direduksi kembali menjadi timbal (Pb), sedangkan timbal sulfat di katoda dioksidasi kembali menjadi timbal dioksida (PbO₂).
3. Reaksi dalam Baterai Lithium-Ion
- Reaksi Discharge:
- Anoda (oksidasi): LiC₆ → Li⁺ + e⁻ + C₆
- Katoda (reduksi): LiCoO₂ + Li⁺ + e⁻ → Li₂CoO₂
Selama discharge, litium (Li) dari anoda (grafit) melepaskan ion litium dan elektron. Ion litium (Li⁺) dan elektron kemudian bergerak ke katoda (litium kobalt oksida), di mana ion litium terakumulasi kembali, mengubah litium kobalt oksida (LiCoO₂) menjadi senyawa yang lebih tereduksi.
- Reaksi Charge:
- Anoda (reduksi): Li⁺ + e⁻ + C₆ → LiC₆
- Katoda (oksidasi): Li₂CoO₂ → LiCoO₂ + Li⁺ + e⁻
Selama pengisian, ion litium (Li⁺) dan elektron bergerak dari katoda kembali ke anoda, mengembalikan grafit ke bentuk LiC₆ dan mengubah litium kobalt oksida (Li₂CoO₂) kembali menjadi bentuk LiCoO₂.
4. Reaksi dalam Baterai Alkaline
- Reaksi Discharge:
- Anoda (oksidasi): Zn + 2OH⁻ → ZnO + H₂O + 2e⁻
- Katoda (reduksi): 2MnO₂ + H₂O + 2e⁻ → Mn₂O₃ + 2OH⁻
Dalam baterai alkaline, zinc (Zn) di anoda mengalami oksidasi, melepaskan elektron dan membentuk zinc oksida (ZnO). Di katoda, mangan dioksida (MnO₂) mengalami reduksi dengan bantuan elektron dan air untuk membentuk mangan(III) oksida (Mn₂O₃) dan hidroksida (OH⁻).
- Reaksi Charge:
- Anoda (reduksi): ZnO + H₂O + 2e⁻ → Zn + 2OH⁻
- Katoda (oksidasi): Mn₂O₃ + 2OH⁻ → 2MnO₂ + H₂O + 2e⁻
Selama pengisian, zinc oksida (ZnO) diubah kembali menjadi zinc (Zn) dan hidroksida (OH⁻) dihasilkan di anoda, sementara mangan(III) oksida (Mn₂O₃) di katoda mengalami oksidasi kembali menjadi mangan dioksida (MnO₂).
5. Reaksi dalam Baterai Nikel-Kadmium (NiCd)
- Reaksi Discharge:
- Anoda (oksidasi): 2NiO(OH) + 2H₂O + 2e⁻ → 2Ni(OH)₂ + 2OH⁻
- Katoda (reduksi): Cd(OH)₂ + 2e⁻ → Cd + 2OH⁻
Dalam baterai NiCd, nikel oksida (NiO(OH)) di anoda mengalami oksidasi, menghasilkan nikel hidroksida (Ni(OH)₂). Di katoda, kadmium hidroksida (Cd(OH)₂) mengalami reduksi menjadi kadmium (Cd).
- Reaksi Charge:
- Anoda (reduksi): 2Ni(OH)₂ + 2OH⁻ → 2NiO(OH) + 2H₂O + 2e⁻
- Katoda (oksidasi): Cd + 2OH⁻ → Cd(OH)₂ + 2e⁻
Selama pengisian, nikel hidroksida (Ni(OH)₂) diubah kembali menjadi nikel oksida (NiO(OH)) di anoda, sedangkan kadmium (Cd) di katoda mengalami oksidasi kembali menjadi kadmium hidroksida (Cd(OH)₂).
Reaksi kimia dalam baterai melibatkan transfer elektron dan ion antara elektroda selama discharge dan charge. Setiap jenis baterai memiliki reaksi kimia khusus yang menentukan kinerja dan efisiensinya.
Memahami reaksi kimia ini membantu dalam merancang baterai yang lebih efisien dan efektif, serta mengoptimalkan penggunaannya dalam berbagai aplikasi teknologi.
Jenis-Jenis Baterai dan Prinsip Kerjanya
Baterai Primer
Baterai primer adalah baterai sekali pakai yang tidak dapat diisi ulang. Contohnya termasuk baterai alkaline dan baterai lithium. Mereka biasanya digunakan dalam perangkat sekali pakai seperti remote control.
Baterai Sekunder
Baterai sekunder adalah baterai yang dapat diisi ulang. Contoh paling umum adalah baterai lithium-ion dan baterai asam timbal. Mereka sering digunakan dalam perangkat elektronik portabel dan kendaraan listrik.
Aplikasi Elektrokimia dalam Baterai
Baterai Lithium-Ion
Baterai lithium-ion menggunakan elektrolit berbasis lithium dan merupakan salah satu baterai yang paling banyak digunakan saat ini. Mereka terkenal karena densitas energi tinggi dan siklus hidup yang panjang.
Baterai Asam Timah
Baterai asam timbal adalah salah satu jenis baterai tertua yang masih digunakan, terutama dalam kendaraan bermotor. Mereka memanfaatkan reaksi antara asam sulfat dan timah untuk menyimpan energi.
Baterai Nikel-Metal Hidrida (NiMH)
Baterai NiMH adalah alternatif yang ramah lingkungan untuk baterai nikel-kadmium (NiCd). Mereka menawarkan kapasitas yang lebih tinggi dan tidak mengandung bahan beracun.
Peran Elektrolit dalam Baterai
Fungsi Elektrolit
Elektrolit adalah zat yang memungkinkan ion bergerak antara anoda dan katoda. Ini penting untuk menjaga aliran listrik dan memastikan reaksi kimia berjalan dengan efisien.
Jenis-Jenis Elektrolit
- Elektrolit Cair: Seperti larutan asam sulfat dalam baterai asam timbal.
- Elektrolit Padat: Digunakan dalam baterai solid-state untuk meningkatkan keamanan dan stabilitas.
- Elektrolit Gel: Kombinasi dari padat dan cair, sering digunakan dalam baterai lithium-ion.
Inovasi dan Masa Depan Baterai
Baterai adalah komponen krusial dalam teknologi modern, dari perangkat elektronik portabel hingga kendaraan listrik. Seiring dengan berkembangnya teknologi dan kebutuhan akan energi yang lebih efisien dan ramah lingkungan, inovasi dalam baterai terus berkembang. Berikut adalah beberapa inovasi terbaru dan tren masa depan dalam teknologi baterai:
1. Baterai Solid-State
- Definisi: Baterai solid-state menggunakan elektrolit padat daripada elektrolit cair atau gel. Ini menawarkan beberapa keuntungan, termasuk keamanan yang lebih tinggi dan kepadatan energi yang lebih besar.
- Keuntungan: Baterai solid-state dapat mengurangi risiko kebakaran dan ledakan yang terkait dengan elektrolit cair. Mereka juga dapat menawarkan daya tahan yang lebih lama dan pengisian yang lebih cepat.
- Status Pengembangan: Teknologi baterai solid-state masih dalam tahap pengembangan, tetapi perusahaan seperti Toyota dan QuantumScape sedang membuat kemajuan signifikan. Diperkirakan bahwa baterai ini akan menjadi lebih umum dalam beberapa tahun ke depan.
2. Baterai Lithium-Sulfur
- Definisi: Baterai lithium-sulfur (Li-S) menggantikan bahan aktif di katoda dengan sulfur, yang lebih murah dan lebih melimpah dibandingkan bahan konvensional seperti kobalt.
- Keuntungan: Baterai Li-S memiliki kepadatan energi yang sangat tinggi dan biaya bahan yang lebih rendah. Mereka juga lebih ringan dibandingkan baterai lithium-ion konvensional.
- Tantangan: Salah satu tantangan utama adalah siklus hidup yang lebih pendek dan kehilangan kapasitas yang cepat. Penelitian dan pengembangan sedang berfokus pada perbaikan ketahanan dan stabilitas baterai ini.
3. Baterai Lithium-Logam
- Definisi: Baterai lithium-logam menggunakan logam lithium sebagai anoda, menggantikan grafit yang digunakan dalam baterai lithium-ion tradisional.
- Keuntungan: Baterai ini dapat menawarkan kepadatan energi yang lebih tinggi dan kapasitas yang lebih besar karena logam lithium memiliki potensi elektroda yang lebih tinggi dibandingkan grafit.
- Tantangan: Penggunaan logam lithium dapat menyebabkan masalah keamanan seperti dendrit lithium yang dapat menembus separator dan menyebabkan korsleting. Penelitian berfokus pada desain elektroda dan elektrolit yang dapat mengatasi masalah ini.
4. Baterai Aliran (Flow Battery)
- Definisi: Baterai aliran menggunakan dua larutan elektrolit yang dipompa melalui sel reaksi terpisah. Energi disimpan dalam larutan ini, dan kapasitas baterai dapat diperbesar dengan meningkatkan ukuran tangki larutan.
- Keuntungan: Baterai aliran menawarkan skalabilitas yang sangat baik dan siklus hidup yang panjang. Mereka cocok untuk penyimpanan energi dalam skala besar seperti sistem energi terbarukan.
- Status Pengembangan: Teknologi baterai aliran seperti vanadium redox dan zinc-bromine sedang diuji dan digunakan dalam aplikasi skala besar. Mereka terus berkembang untuk meningkatkan efisiensi dan mengurangi biaya.
5. Baterai Grafen
- Definisi: Baterai grafen menggunakan grafen, bentuk karbon dengan struktur dua dimensi, sebagai bahan untuk elektroda. Grafen memiliki konduktivitas yang sangat tinggi dan kekuatan mekanik yang besar.
- Keuntungan: Baterai grafen dapat menawarkan kecepatan pengisian yang sangat cepat, kapasitas yang tinggi, dan daya tahan yang lama. Mereka juga lebih ringan dan fleksibel dibandingkan baterai tradisional.
- Status Pengembangan: Meskipun teknologi grafen menjanjikan, masih ada tantangan dalam produksi massal dan biaya material. Namun, riset terus dilakukan untuk mengatasi masalah ini.
6. Teknologi Baterai Berbasis Natrium
- Definisi: Baterai berbasis natrium menggunakan natrium sebagai pengganti litium dalam elektroda. Natrium lebih melimpah dan lebih murah daripada litium.
- Keuntungan: Baterai natrium-ion dapat mengurangi ketergantungan pada sumber daya litium yang terbatas dan lebih ramah lingkungan.
- Tantangan: Baterai natrium-ion saat ini memiliki kepadatan energi yang lebih rendah dibandingkan dengan baterai lithium-ion. Penelitian sedang dilakukan untuk meningkatkan kinerja dan daya tahan baterai ini.
7. Baterai Biodegradable
- Definisi: Baterai biodegradable dirancang untuk mengurai secara alami setelah digunakan, mengurangi dampak lingkungan dari limbah baterai.
- Keuntungan: Baterai ini dapat mengurangi polusi dan limbah elektronik, serta mengurangi dampak lingkungan dari bahan berbahaya.
- Status Pengembangan: Teknologi ini masih dalam tahap penelitian dan pengembangan, dengan fokus pada penggunaan bahan alami dan proses yang ramah lingkungan.
8. Baterai dengan Teknologi Pengisian Cepat
- Definisi: Baterai dengan teknologi pengisian cepat dirancang untuk mengurangi waktu pengisian dari beberapa jam menjadi beberapa menit.
- Keuntungan: Teknologi ini sangat berguna untuk aplikasi seperti kendaraan listrik dan perangkat elektronik yang memerlukan pengisian cepat dan efisien.
- Contoh: Beberapa baterai lithium-ion canggih sudah mulai menawarkan kemampuan pengisian cepat, dan penelitian terus dilakukan untuk meningkatkan kecepatan pengisian tanpa mengorbankan umur baterai.
Inovasi dalam teknologi baterai terus berkembang dengan tujuan meningkatkan kapasitas, efisiensi, keamanan, dan keberlanjutan. Dari baterai solid-state dan lithium-sulfur hingga baterai grafen dan teknologi berbasis natrium, setiap kemajuan menawarkan potensi untuk mengubah cara kita menggunakan energi dalam kehidupan sehari-hari dan industri.
Masa depan baterai tampak cerah dengan kemungkinan teknologi baru yang dapat memenuhi kebutuhan energi global yang semakin meningkat dan mendukung transisi menuju energi yang lebih bersih dan efisien.
Kesimpulan
Dalam artikel ini, kita telah menjelajahi konsep dasar elektrokimia dan bagaimana prinsip-prinsipnya diterapkan dalam berbagai jenis baterai. Dari baterai lithium-ion yang canggih hingga baterai asam timbal yang klasik, setiap jenis baterai memiliki prinsip elektrokimia yang unik dan penting. Dengan pemahaman yang lebih baik tentang bagaimana baterai bekerja, kita bisa lebih menghargai teknologi yang mendukung kehidupan sehari-hari kita.
FAQ
- Apa itu elektrokimia? Elektrokimia adalah cabang kimia yang mempelajari hubungan antara energi listrik dan reaksi kimia.
- Bagaimana cara kerja baterai lithium-ion? Baterai lithium-ion menggunakan elektrolit berbasis lithium dan menghasilkan energi listrik melalui reaksi redoks di anoda dan katoda.
- Apa perbedaan antara baterai primer dan sekunder? Baterai primer tidak dapat diisi ulang, sementara baterai sekunder bisa diisi ulang.
- Mengapa baterai solid-state dianggap lebih aman? Baterai solid-state menggunakan elektrolit padat, mengurangi risiko kebocoran dan kebakaran dibandingkan dengan elektrolit cair.
- Apa itu baterai berbasis sodium? Baterai berbasis sodium adalah alternatif untuk baterai lithium, menggunakan natrium sebagai pengganti lithium.
 Mata Pelajaran Berbagi Ilmu Pengetahuan
Mata Pelajaran Berbagi Ilmu Pengetahuan



